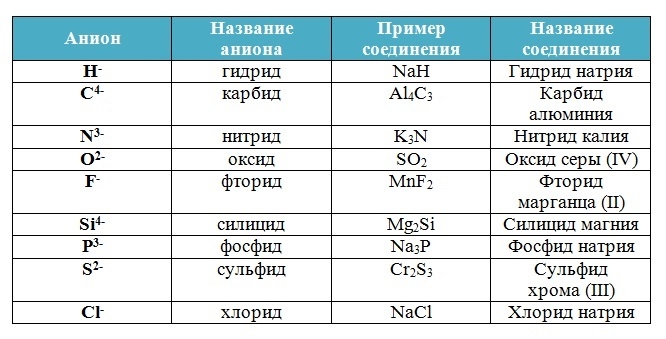
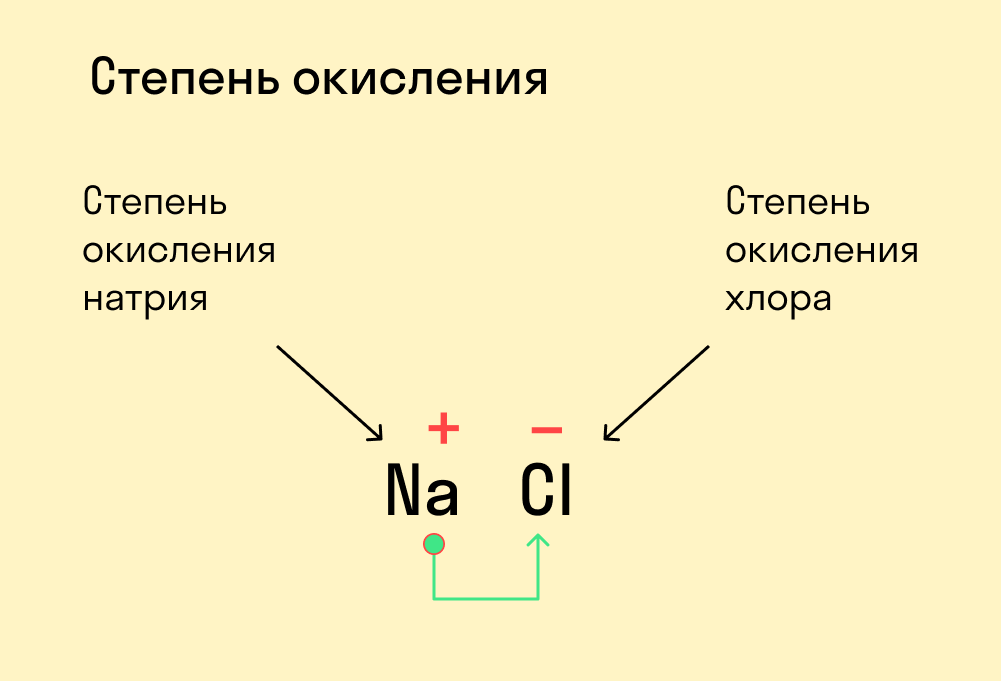
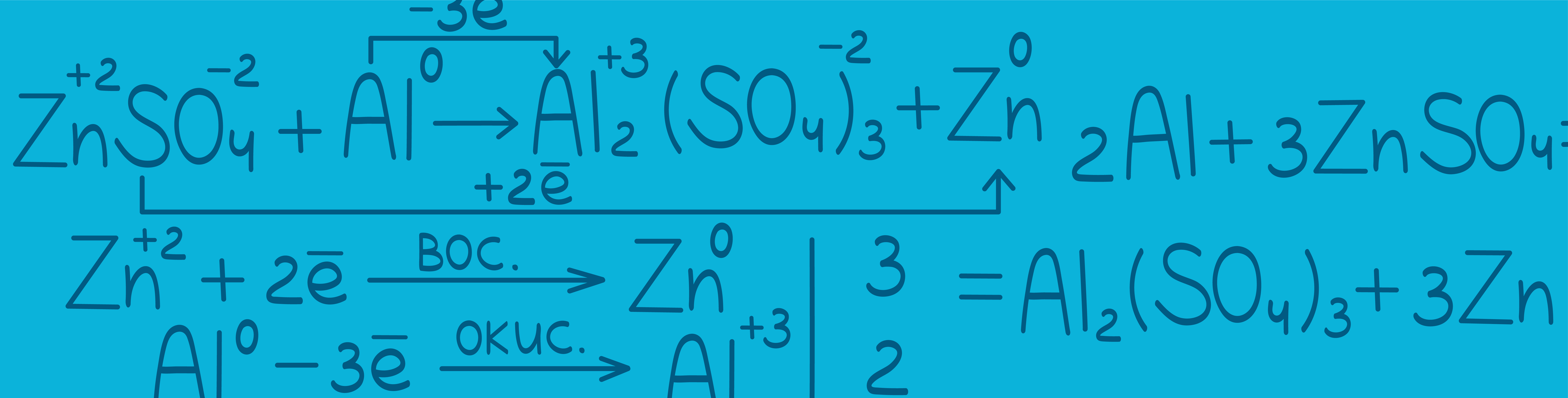Ferrous (Fe) — Железо
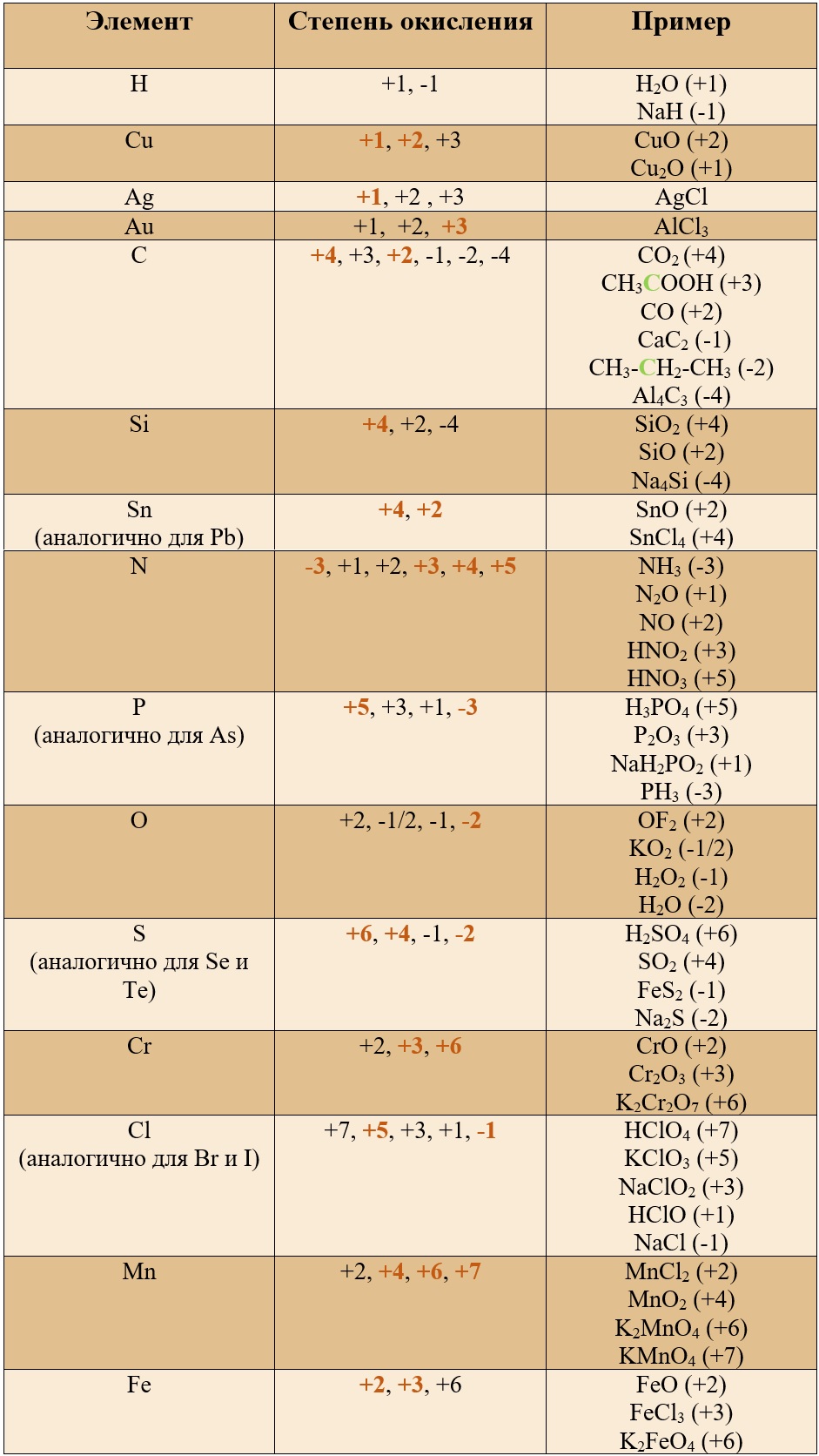
Этот список показывает все известные степени окисления химических элементов. Исключениями являются дробные значения. Наиболее часто встречающиеся степени окисления выделены жирным шрифтом. Этот список основан на таблице Гринвуда [ 1 ] со всеми дополнениями.

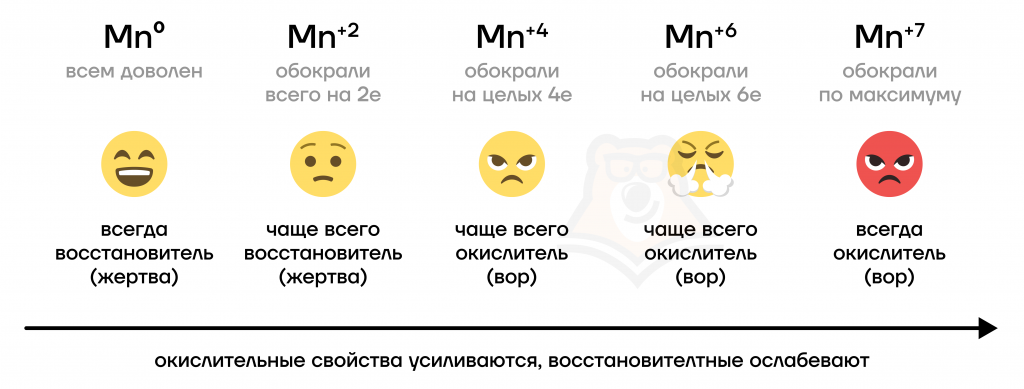
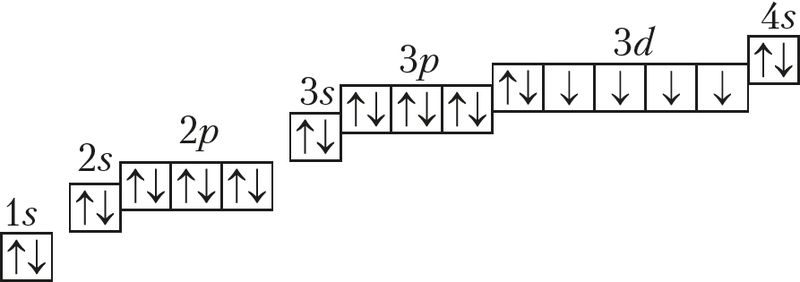
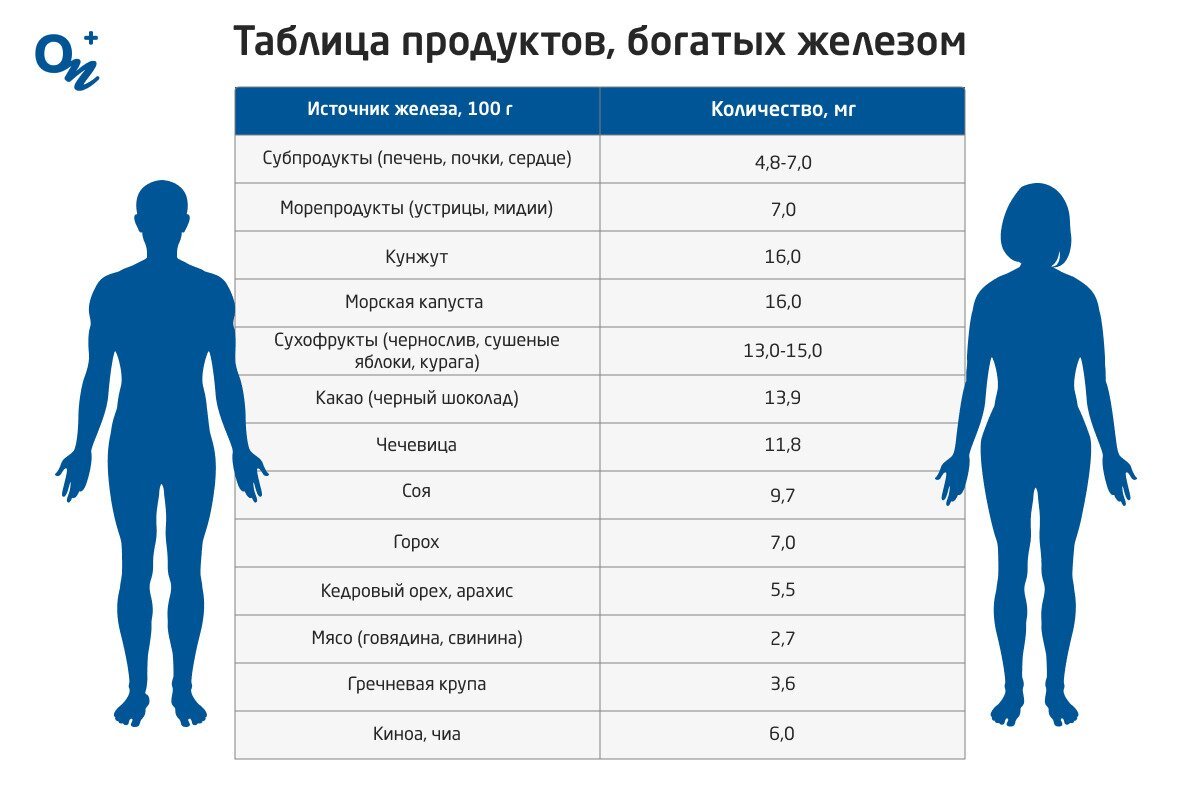



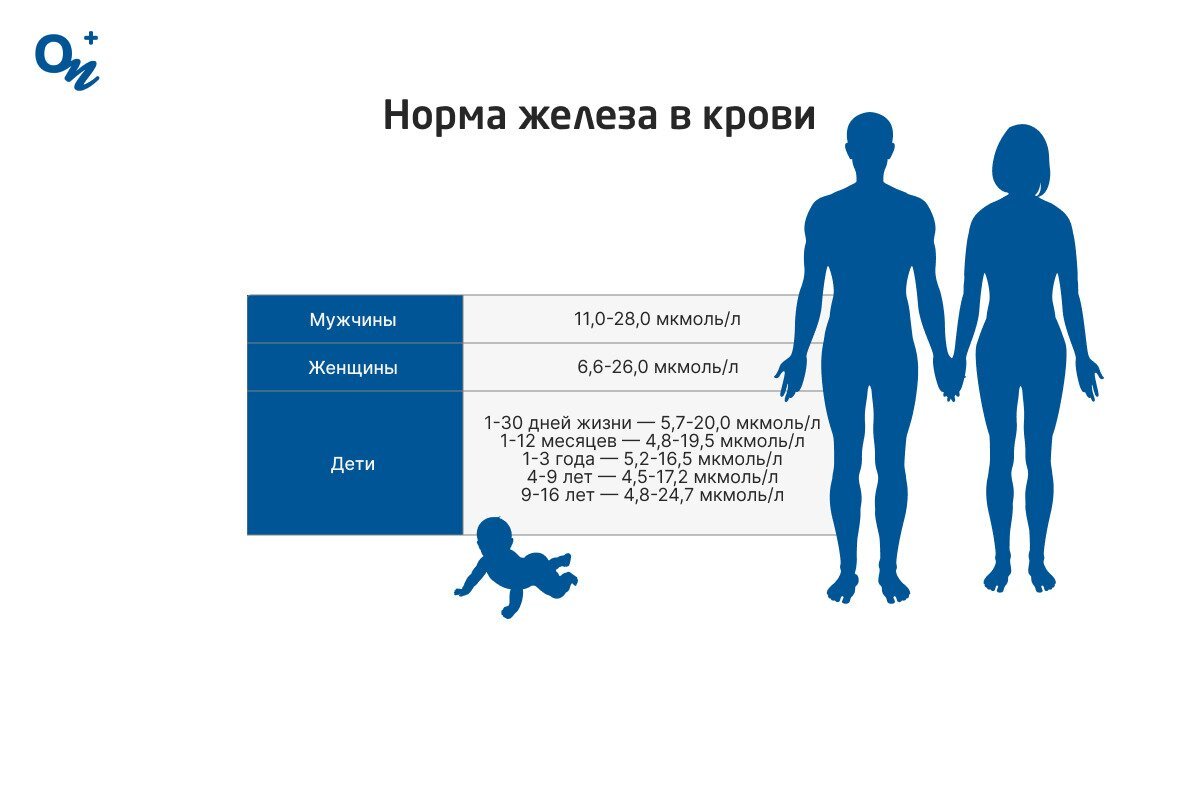




Железо — типичный металл , в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен , различные примеси в частности — углерод повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую « триаду железа » — группу трёх металлов железо Fe, кобальт Co, никель Ni , обладающих схожими физическими свойствами , атомными радиусами и значениями электроотрицательности. Fe OH 3 растворяется и то не полностью , только в концентрированных щелочах.




Оксид железа II — порошок черного цвета, в мелкораздробленном состоянии воспламеняется. Кристаллизуется в структурном типе хлорида натрия кубическая гранецентрированная решетка. Проявляет преимущественно основные свойства.